数据完整性辨析
发布时间:2015-12-04 浏览次数:1822次
近年来,世界各国的药品监管部分大量关于电子记录的警告信、检查报告激增,一时将电子数据完整性问题推到风口浪尖,成为行业热门话题。质量管理方面的供应商喜笑颜开,而制药厂商们则开始愁眉苦脸。对数据完整性推崇备至者有之,对其口诛笔伐者也有之。虽说数据不完整不代表一定会出质量问题,但带来的影响不可谓不大。美国食药监局(FDA)对浙江海正药业所属台州工厂发出数据完整性不足的警告,阿卡波糖等15个原料药将暂时不能进入美国市场。
对数据完整性的定义,不同行业所赋予的意义是不一样的。如果你用百度去搜索,结果大多显示的是IT行业所定义的完整性,多半与数据库有关。而FDA,MHRA所定义的数据完整性则是从产品质量相关数据的角度出发的。下面列举了数据完整性的五个定义,分别是英国MHRA,美国FDA,美国科学和技术研究院(NIST)的定义,最后一个是美国电子和电气工程师协会(IEEE)的定义。可以看出,不同的组织,或同一监管机构的不同的部门,对同一概念都可能有不同的理解。
数据完整性和完整性的定义

把这些来源各异的数据完整定义求综合一下,我们可以得出数据完整性的特点如下:
• 数据必须是完整的,一致的和准确的(MHRA和FDA的第1和第2条)
• 数据具有完整的生命周期(MHRA,NIST)
• 数据应禁止不当修改(FDA,NIST)
• 如果使用计算机系统,软件应能防止对数据进行未授权的修改(FDA第2条,IEEE)
前三点并没有设定对操作方式的要求,我们可以认为对纯人工操作、混合系统和计算机化系统都适用,第四点则明确提出了前提是使用了计算机系统,适用对象是混合系统和计算机化系统。
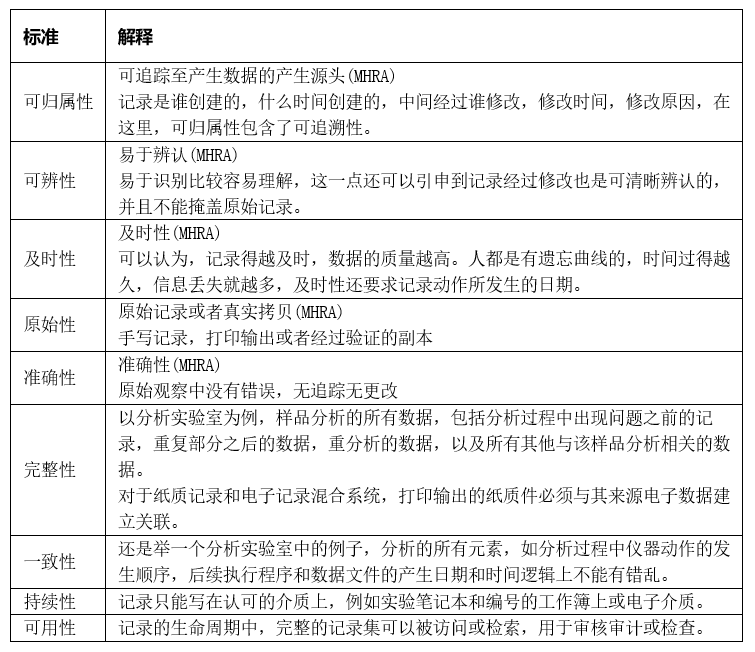
如果对上面的说明大家还是雾里看花的话,那么下面介绍的ALCOA原则说得比较具体。ALCOA是从对GLP记录的要求援引而来,分别代表Attributable(可归属性)、Legible(可读性)、Contemporaneous(及时性)、Original(原始性)、Accurate(准确性)等五个单词的首字母。大家可以看出这五个要求是完全针对纸质记录而言的,对电子记录而言还不完全适合。后来,在ALCOA的基础上又引入了EMA GCP对电子记录的要求:Complete(完整性)、Consistent(一致性)、Enduring(持久性)、Available(可用性)。我们可以将其被概括总结为ALCOA +原则,从而成为数据质量评价的标准。
数据完整性的ALCOA+标准